Lésions nerveuses périphériques
 |
| Wang M. et al. Peripheral nerve injury, scarring, and recovery. Connective Tissue Research 2019, 60(1):3-9. |
Lésion, cicatrisation et récupération du nerf périphérique.
Les lésions traumatiques des nerfs périphériques sont des blessures potentiellement dévastatrices, représentant 2 % de tous les traumatismes des extrémités. Jusqu'à 33% de toutes les lésions des nerfs périphériques présentent une récupération neurale incomplète, ce qui affecte la fonction. Ces séquelles engendrent un handicap permanent associé notamment à une perte ou à une récupération partielle des fonctions sensitives et/ou motrices, à une douleur chronique, à une atrophie des muscles cibles et à une faiblesse profonde.
D'un point de vue biologique, la cicatrisation de la lésion nerveuse et de son environnement représente un facteur majeur limitant la récupération fonctionnelle optimale. Une adhérence cicatricielle périneurale risque de perturber la restauration fonctionnelle du nerf, et représente un problème qui reste insuffisamment pris en compte. Cette revue traite de l'impact négatif de la cicatrisation sur la lésion du nerf périphérique, et aborde les stratégies biologiques actuelles permettant de minimiser l'adhérence périneurale et ainsi d'améliorer la récupération fonctionnelle.
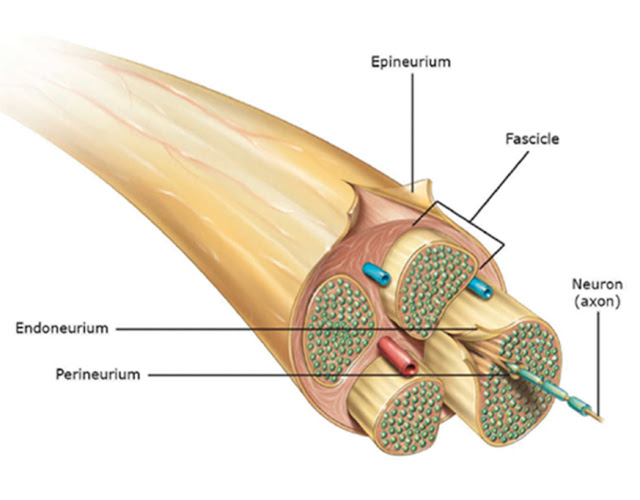
Chaque nerf périphérique ou tronc nerveux, est composé de multiples assemblages longitudinaux de groupes d'axones, connus sous le nom de fascicules. Aussi communément appelés fibres nerveuses, les axones sont des portions de conduction allongées de neurones. En coupe transversale et sous agrandissement, les fascicules d'un nerf périphérique sont facilement discernables les uns des autres. Le tissu conjonctif soutient ces fascicules. Sa couche la plus externe, appelée épinèvre épifasciculaire, forme une gaine contenant tous les fascicules qui s'unissent pour former le nerf périphérique. Ce tissu conjonctif lâche relie également les fascicules entre eux, il porte ici le nom d'épinèvre interfasciculaire. L'épinèvre est formé de tissu conjonctif aréolaire, qui permet l'expansion et le repliement du nerf au cours de la flexion et de l'extension. Un tissu conjonctif spécialisé plus fin, appelé périnèvre, enveloppe directement chaque fascicule, il contribue à maintenir l'homéostasie au sein de cette structure. Enfin, une fine couche de fibres de collagène, l'endonèvre, relie les axones au sein du fascicule.
Bien que les nerfs périphériques soient composés de neurones moteurs et sensoriels dans des proportions variables, les nerfs moteurs possèdent principalement des axones myélinisés, tandis que les nerfs sensoriels sont généralement composés d'axones non myélinisés. Chaque axone myélinisé est associé à sa propre cellule de Schwann, capable de produire des couches de myéline riches en laminine, formant ainsi une membrane grasse multicouche qui isole l'axone et permet la propagation rapide des impulsions par conduction saltatoire. La myélinisation accélère la conduction nerveuse de 20 à 100 fois par rapport aux axones non myélinisés de même taille. Les axones non myélinisés sont souvent plus petits que leurs homologues myélinisés ; ainsi, plusieurs axones peuvent être maintenus par une seule cellule de Schwann. En plus de leur rôle dans le processus de myélinisation, les cellules de Schwann sont les principaux médiateurs extrinsèques de la régénération des nerfs périphériques. Les fibroblastes du tissu conjonctif participent également à ce processus en s'accumulant dans la zone de lésion nerveuse et en organisant les cellules de Schwann par le biais de processus de signalisation.
Les péricytes constituent un autre type de cellule essentiel à l'environnement du nerf périphérique. Ce sont des cellules contractiles associées au revêtement endothélial des microvasculatures et modulent la dilatation des capillaires et le flux sanguin. Dans tout le système nerveux périphérique, les péricytes sont associés au maintien de l'homéostasie dans le microenvironnement endoneuriel, ainsi que dans la barrière cerveau-nerf.
Il existe deux classifications des lésions nerveuses périphériques. En 1943, Herbert Seddon propose trois groupes de lésions du nerf périphérique :
(1) neurapraxie (neurapraxia), ou lésion neurale due à la compression ou à la traction, sans lésion nerveuse structurelle ;
(2) axonotmésis (axonotmesis), ou perte de continuité des axones ;
(3) neurotmésis (neurotmesis), ou transection ou perturbation complète du nerf dans sa totalité.
Cette classification des lésions nerveuses périphériques a été affinée en 1951 par Sidney Sunderland, qui a introduit cinq types de lésions nerveuses périphériques, basés sur la gravité croissante des dommages de la structure nerveuse.
Type 1 : démyélinisation locale. Récupération totale entre 1 jour et 3 mois ;
Type 2 : lésion des axones, mais l'endonèvre, le périnèvre et l'épinèvre restent intacts. Récupération totale entre 2 et 4 mois ;
Type 3 : lésion des axones et de l'endonèvre, le périnèvre et l'épinèvre restent intacts. Récupération partielle qui nécéssite environ 12 mois ;
Type 4 : lésion des axones, de l'endonèvre et du périnèvre, l'épinèvre reste intact. Récupération qui nécéssite de la chirurgie.
Type 5 : lésion complète avec perte de la continuité neuronale. Récupération qui nécéssite de la chirurgie.
La cicatrisation nerveuse extrinsèque, ou adhérence extraneurale, se produit à la périphérie de l'épinèvre. Une adhérence extraneurale excessive peut affecter le glissement du nerf, provoquer une fixation ou une compression du nerf, et diminuer les vitesses normales de conduction nerveuse, ce qui finit par altérer le signal nerveux vers les territoires cibles sensitifs et moteurs. La cicatrisation nerveuse intrinsèque, ou fibrose intraneurale, se produit à l'intérieur de la substance neurale et peut entourer les structures neurales à tous les niveaux, ainsi la couche périneurale enveloppera les fascicules nerveux et l'endonèvre chaque axone myélinisé. La cicatrisation intrinsèque reste problématique, car la fibrose intraneurale peut altérer la microvascularisation périneurale, entraver la migration axonale et nuire à la régénération nerveuse.
La prise en charge d'une lésion nerveuse correspondant à une axonotmésis (interruption de la continuité des axones et de la gaine de myéline) classique de Seddon, ou plus précisément à des lésions de type 2, 3, 4 ou 5 de Sunderland (où il y a perte de continuité des axones ou perturbation supplémentaire de l'endonèvre, du périnèvre ou de l'épinèvre), continue à représenter une tâche interventionnelle difficile, car le processus dégénératif wallérien peut se manifester dans les 48 à 72 heures suivant la blessure. Pour que la régénération nerveuse soit réussie, les axones doivent progresser de manière antérograde le long du tube endoneural. Cependant, une fibrose intraneurale excessive peut entraver ou détourner la migration normale des neurones de sa trajectoire axonale optimale.
Lésion nerveuse; cicatrisation; nerf périphérique; adhérence extraneurale; fibrose intrafasciculaire.
Photo provenant d'AxoGen Inc