Tennis Elbow
Neuropathie du nerf mandibulaire
Piagkou M. et al. Functional anatomy of the mandibular nerve: consequences of nerve injury and entrapment. Clinical Anatomy 2011, 24(2):143-50.
Cyclisme et nerf pudendal

Dysfonction sexuelle
Photo de Jasmine Carter provenant de Pexels.com
Névralgie d'Arnold

Son tableau clinique est constitué d´une douleur paroxystique unilatérale ou bilatérale, fulgurante ou lancinante, se manifestant dans la région postérieure du cuir chevelu, dans le ou les territoires d´innervation du grand, du petit ou du troisième nerf occipital, parfois accompagnée d'une diminution de la sensibilité ou d'une dysesthésie dans la zone affectée et généralement associée à une hypersensibilité du ou les nerfs impliqués.
Critères diagnostiques selon la classification internationale
A. Douleur unilatérale ou bilatérale dans le ou les territoires d´innervation des nerfs grand, petit ou troisième occipital, répondant aux critères B-D.
B. La douleur présente au moins deux des trois caractéristiques suivantes :
1. récurrente, en crises paroxystiques durant de quelques secondes à quelques minutes
2. d'intensité sévère
3. de qualité fulgurante, lancinante ou aiguë.
C. La douleur est associée aux deux caractéristiques suivantes
1. une dysesthésie et/ou une allodynie apparaissant lors d'une stimulation inoffensive du cuir chevelu et/ou des cheveux
2. l'un et/ou l'autre des deux éléments suivants
a) sensibilisation du nerf affecté et de ses branches
b) points trigger neurogènes au niveau de l'émergence des nerfs occipitaux ou douleur dans les territoires d´innervation
D. La douleur est soulagée temporairement par un bloc anesthésique local du ou des nerfs concernés
E. Ne correspond pas mieux à un autre diagnostic ICHD-3
La neuralgie occipitale peut atteindre la région fronto-orbitaire par l'intermédiaire des connexions interneuronales trigémino-cervicales dans les noyaux spinaux trigéminaux. Elle doit être distinguée de la douleur provenant des articulations atlanto-axoïdiennes et zygapophysaires supérieures et/ou des points trigger des muscles de la tête, du cou, de la nuque et de leurs insertions.
Syndrome de Maigne
Cyclisme et neuropathies du membre supérieur
 |
Photo de Roman Pohorecki provenant de Pexels.comCyr A. Cervical Spine, Upper Extremity Neuropathies, and Overuse Injuries in Cyclists. Physical Medicine and Rehabilitation Clinics of North America 2022, 33(1):187-199.Colonne cervicale, neuropathies des membres supérieurs et lésions de surmenage chez les cyclistes. Les lésions nerveuses des membres supérieurs chez les cyclistes comprennent le syndrome du canal carpien et la neuropathie ulnaire au niveau du poignet (syndrome du canal de Guyon). L'électromyographie et les études de conduction nerveuse aident au diagnostic des neuropathies. L'échographie ou l'IRM peuvent également être utiles pour l'évaluation. Les lésions de surmenage des membres supérieurs comprennent le coude du cycliste, ou une tendinopathie des tendons des muscles fléchisseurs du poignet et des doigts ou des muscles extenseurs communs des doigts, plus fréquente en cas de pratique de mountain bike. Les douleurs cervicales sont également fréquentes chez les cyclistes. Le traitement de ces affections varie de la gestion conservatrice aux options chirurgicales, mais une évaluation de l'ajustement du vélo est recommandée pour tout symptôme persistant. |
Biker's elbow; syndrome du canal carpien; syndrome du canal de Guyon; douleurs cervicales; neuropathie ulnaire.
Syndrome T4
 |
Löscher S. Handschuhe, Helm- und Schweregefühl - Das T4-Syndrom. Physiopraxis 2021, 19(03):24-29. |
Lésions nerveuses périphériques
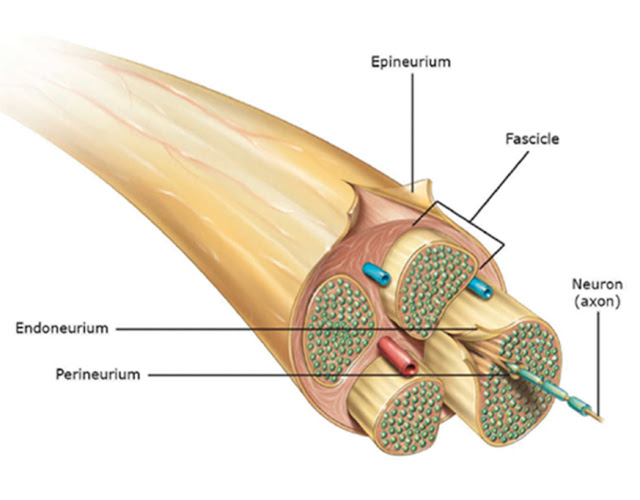 |
| Wang M. et al. Peripheral nerve injury, scarring, and recovery. Connective Tissue Research 2019, 60(1):3-9. |
Les péricytes constituent un autre type de cellule essentiel à l'environnement du nerf périphérique. Ce sont des cellules contractiles associées au revêtement endothélial des microvasculatures et modulent la dilatation des capillaires et le flux sanguin. Dans tout le système nerveux périphérique, les péricytes sont associés au maintien de l'homéostasie dans le microenvironnement endoneuriel, ainsi que dans la barrière cerveau-nerf.
Il existe deux classifications des lésions nerveuses périphériques. En 1943, Herbert Seddon propose trois groupes de lésions du nerf périphérique :





