Lésions nerveuses périphériques
 |
| Wang M. et al. Peripheral nerve injury, scarring, and recovery. Connective Tissue Research 2019, 60(1):3-9. |
Lésion, cicatrisation et récupération du nerf périphérique.
Les lésions traumatiques des nerfs périphériques sont des blessures potentiellement dévastatrices, représentant 2 % de tous les traumatismes des extrémités. Jusqu'à 33% de toutes les lésions des nerfs périphériques présentent une récupération neurale incomplète, ce qui affecte la fonction. Ces séquelles engendrent un handicap permanent associé notamment à une perte ou à une récupération partielle des fonctions sensitives et/ou motrices, à une douleur chronique, à une atrophie des muscles cibles et à une faiblesse profonde.
D'un point de vue biologique, la cicatrisation de la lésion nerveuse et de son environnement représente un facteur majeur limitant la récupération fonctionnelle optimale. Une adhérence cicatricielle périneurale risque de perturber la restauration fonctionnelle du nerf, et représente un problème qui reste insuffisamment pris en compte. Cette revue traite de l'impact négatif de la cicatrisation sur la lésion du nerf périphérique, et aborde les stratégies biologiques actuelles permettant de minimiser l'adhérence périneurale et ainsi d'améliorer la récupération fonctionnelle.
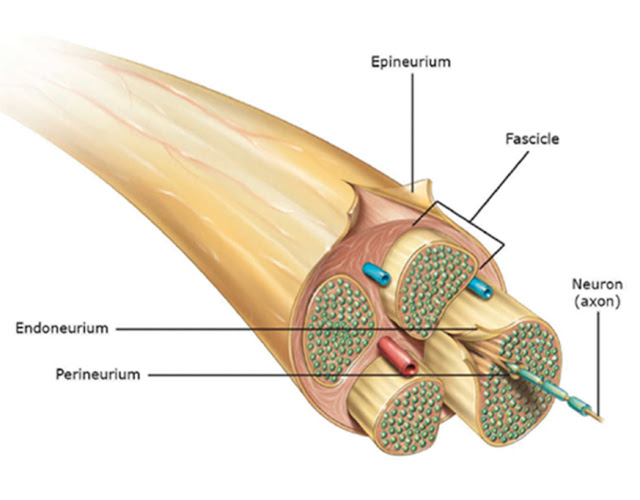
Chaque nerf périphérique ou tronc nerveux, est composé de multiples assemblages longitudinaux de groupes d'axones, connus sous le nom de fascicules. Aussi communément appelés fibres nerveuses, les axones sont des portions de conduction allongées de neurones. En coupe transversale et sous agrandissement, les fascicules d'un nerf périphérique sont facilement discernables les uns des autres. Le tissu conjonctif soutient ces fascicules. Sa couche la plus externe, appelée épinèvre épifasciculaire, forme une gaine contenant tous les fascicules qui s'unissent pour former le nerf périphérique. Ce tissu conjonctif lâche relie également les fascicules entre eux, il porte ici le nom d'épinèvre interfasciculaire. L'épinèvre est formé de tissu conjonctif aréolaire, qui permet l'expansion et le repliement du nerf au cours de la flexion et de l'extension. Un tissu conjonctif spécialisé plus fin, appelé périnèvre, enveloppe directement chaque fascicule, il contribue à maintenir l'homéostasie au sein de cette structure. Enfin, une fine couche de fibres de collagène, l'endonèvre, relie les axones au sein du fascicule.
Bien que les nerfs périphériques soient composés de neurones moteurs et sensoriels dans des proportions variables, les nerfs moteurs possèdent principalement des axones myélinisés, tandis que les nerfs sensoriels sont généralement composés d'axones non myélinisés. Chaque axone myélinisé est associé à sa propre cellule de Schwann, capable de produire des couches de myéline riches en laminine, formant ainsi une membrane grasse multicouche qui isole l'axone et permet la propagation rapide des impulsions par conduction saltatoire. La myélinisation accélère la conduction nerveuse de 20 à 100 fois par rapport aux axones non myélinisés de même taille. Les axones non myélinisés sont souvent plus petits que leurs homologues myélinisés ; ainsi, plusieurs axones peuvent être maintenus par une seule cellule de Schwann. En plus de leur rôle dans le processus de myélinisation, les cellules de Schwann sont les principaux médiateurs extrinsèques de la régénération des nerfs périphériques. Les fibroblastes du tissu conjonctif participent également à ce processus en s'accumulant dans la zone de lésion nerveuse et en organisant les cellules de Schwann par le biais de processus de signalisation.
Les péricytes constituent un autre type de cellule essentiel à l'environnement du nerf périphérique. Ce sont des cellules contractiles associées au revêtement endothélial des microvasculatures et modulent la dilatation des capillaires et le flux sanguin. Dans tout le système nerveux périphérique, les péricytes sont associés au maintien de l'homéostasie dans le microenvironnement endoneuriel, ainsi que dans la barrière cerveau-nerf.
Il existe deux classifications des lésions nerveuses périphériques. En 1943, Herbert Seddon propose trois groupes de lésions du nerf périphérique :
(1) neurapraxie (neurapraxia), ou lésion neurale due à la compression ou à la traction, sans lésion nerveuse structurelle ;
(2) axonotmésis (axonotmesis), ou perte de continuité des axones ;
(3) neurotmésis (neurotmesis), ou transection ou perturbation complète du nerf dans sa totalité.
Cette classification des lésions nerveuses périphériques a été affinée en 1951 par Sidney Sunderland, qui a introduit cinq types de lésions nerveuses périphériques, basés sur la gravité croissante des dommages de la structure nerveuse.
Type 1 : démyélinisation locale. Récupération totale entre 1 jour et 3 mois ;
Type 2 : lésion des axones, mais l'endonèvre, le périnèvre et l'épinèvre restent intacts. Récupération totale entre 2 et 4 mois ;
Type 3 : lésion des axones et de l'endonèvre, le périnèvre et l'épinèvre restent intacts. Récupération partielle qui nécéssite environ 12 mois ;
Type 4 : lésion des axones, de l'endonèvre et du périnèvre, l'épinèvre reste intact. Récupération qui nécéssite de la chirurgie.
Type 5 : lésion complète avec perte de la continuité neuronale. Récupération qui nécéssite de la chirurgie.
La cicatrisation nerveuse extrinsèque, ou adhérence extraneurale, se produit à la périphérie de l'épinèvre. Une adhérence extraneurale excessive peut affecter le glissement du nerf, provoquer une fixation ou une compression du nerf, et diminuer les vitesses normales de conduction nerveuse, ce qui finit par altérer le signal nerveux vers les territoires cibles sensitifs et moteurs. La cicatrisation nerveuse intrinsèque, ou fibrose intraneurale, se produit à l'intérieur de la substance neurale et peut entourer les structures neurales à tous les niveaux, ainsi la couche périneurale enveloppera les fascicules nerveux et l'endonèvre chaque axone myélinisé. La cicatrisation intrinsèque reste problématique, car la fibrose intraneurale peut altérer la microvascularisation périneurale, entraver la migration axonale et nuire à la régénération nerveuse.
La prise en charge d'une lésion nerveuse correspondant à une axonotmésis (interruption de la continuité des axones et de la gaine de myéline) classique de Seddon, ou plus précisément à des lésions de type 2, 3, 4 ou 5 de Sunderland (où il y a perte de continuité des axones ou perturbation supplémentaire de l'endonèvre, du périnèvre ou de l'épinèvre), continue à représenter une tâche interventionnelle difficile, car le processus dégénératif wallérien peut se manifester dans les 48 à 72 heures suivant la blessure. Pour que la régénération nerveuse soit réussie, les axones doivent progresser de manière antérograde le long du tube endoneural. Cependant, une fibrose intraneurale excessive peut entraver ou détourner la migration normale des neurones de sa trajectoire axonale optimale.
Lésion nerveuse; cicatrisation; nerf périphérique; adhérence extraneurale; fibrose intrafasciculaire.
Photo provenant d'AxoGen Inc
L'anatomie du nerf fibulaire superficiel

Variations du nerf fibulaire superficiel lors de son émergence fasciale : Méta-analyse et considération clinique.
Le nerf fibulaire (péronier) superficiel est l'une des branches du nerf fibulaire (péronier) commun, il donne naissance aux nerfs cutanés dorsal médian et dorsal intermédiaire. Le nerf fibulaire superficiel est le principal contributeur à l'innervation sensitive du cou-de-pied et de la partie inférieure de la jambe. Sa façon de pénétrer le fascia profond (crural) qui varie considérablement d'un individu à l'autre, et les différences dans son parcours ultérieur peuvent favoriser les blessures iatrogènes. Des articles sur la prévalence de ces variations anatomiques ont été identifiés par une recherche exhaustive dans les bases de données. Les données recueillies ont été regroupées dans une méta-analyse basée sur 14 articles (n = 665 membres inférieurs) traitant des variations du passage du nerf fibulaire superficiel dans les fascias. La configuration anatomique la plus fréquente de type 1, où le nerf fibulaire superficiel transperce le fascia profond en tant qu'entité et se divise ensuite en nerfs cutanés dorsaux médial et intermédiaire, présente une prévalence combinée de 82,7%. La variante de type 2, où le nerf fibulaire superficiel se divise plus tôt et où ses branches terminales transpercent ensuite individuellement la couche aponévrotique présente une prévalence combinée de 15,6%. Le type 3, où le nerf fibulaire superficiel pénètre dans le fascia profond et se termine en nerf cutané dorsal médial, le nerf cutané dorsal intermédiaire reste ici absent, est observé dans 1,8% des cas. Une partie substantielle de la population présente donc un modèle de perçage du nerf fibulaire superficiel qui s'écarte de l'anatomie courante de type 1. Il est recommandé d'examiner minutieusement les éventuelles variantes du nerf fibulaire superficiel chez les patients afin d'aider à prévenir les blessures iatrogènes et les complications postopératoires.
Anatomie et physiologie du nerf fibulaire superficiel
Le nerf ischiatique formé de fibres des nerfs rachidiens de L4 à S3, se termine au niveau de l'apex du creux poplité pour donner naissance au nerf fibulaire commun et au nerf tibial. Le nerf fibulaire commun est composé de fibres provenant des nerfs rachidiens L4 à S2. Lorsqu'il s'enroule autour du col du péroné il se divise en deux branches, le nerf fibulaire superficiel et le nerf fibulaire profond. Le nerf fibulaire superficiel est le plus fin des deux, il chemine sous le muscle long fibulaire et innerve les muscles long et court fibulaires. Le nerf émerge au travers des muscles fibulaires à la face antérolatérale de la moitié inférieure de la jambe, à environ 12 cm au-dessus de l'articulation de la cheville, au niveau d'un défaut de l'aponévrose crurale, également appelée aponévrose profonde de la jambe.
Le nerf fibulaire superficiel est un nerf mixte. Ses fibres motrices innervent les muscles de la loge latérale de la jambe, principalement responsables de l´éversion et de la flexion plantaire du pied. Le muscle long fibulaire est également impliqué dans le soutien de la voûte plantaire. Les branches terminale du nerf connues sous les noms de nerf cutané dorsal médial (la plus grande des deux branches) et de nerf cutané dorsal intermédiaire, assurent l'innervation sensitive de la face antérolatérale de la jambe, du dos du pied et de la face dorsale des orteils, à l'exception de la peau du premier espace entre le gros orteil et le deuxième orteil, innervée par la branche sensitive du nerf fibulaire profond (nerf cutané dorsal du nerf fibulaire profond).
En plus des variations de son émergence du fascia crural, si le nerf fibulaire superficiel chemine la plupart du temps au sein de la loge latérale de la jambe, on observe aussi des variantes anatomique à ce niveau. Selon une étude réalisée en Inde, chez 28,3% des spécimens cadavériques le nerf fibulaire superficiel cheminait au sein de la loge antérieure de la jambe.
La lésion du nerf fibulaire superficiel peut perturber la sensibilité au niveau de la région inféro-latérale de la jambe, du cou-de-pied et de la face dorsale du pied (à l'exception du premier espace entre le gros orteil et le deuxième orteil où c'est le nerf fibulaire profond qui fournit l'innervation sensitive). Cette symptomatologie peut accompagner une lésion directe du nerf fibulaire commun, survenant au cours d'un coup porté sur la face latérale du genou ou d'une fracture de la tête du péroné. Le nerf fibulaire superficiel peut également être coincé, ce qui peut entraîner des douleurs et des paresthésies dans la partie inférieure de la jambe, ainsi que sur le dos du pied. La compression du nerf peut être secondaire à une entorse de la cheville ou à une blessure par torsion de la cheville, qui entraîne l'étirement du nerf au niveau de la cheville et/ou du pied. De plus, le nerf peut également être comprimé par le fascia chez un patient souffrant d'un syndrome de loge aigu ou chronique, ce qui entraîne une réduction du flux sanguin et de l'apport d'oxygène au nerf. Une décompression chirurgicale est alors nécessaire pour soulager la douleur et les autres symptômes, en particulier dans le contexte aigu.
Nerf fibulaire commun, nerf fibulaire superficiel ; nerfs cutanés dorsaux du pied ; neurocompression.
Photo de Lazy Artist Gallery provenant de Pexels.com
Fascias et kinésiotaping
Enquête sur l'efficacité de deux techniques différentes de kinésiotaping dans le syndrome myofascial douloureux : Un essai clinique ouvert et randomisé.
Les auteurs trouvent que deux modalités de kinésiotaping (en inhibition et en space) sur un muscle trapèze supérieur présentant un point trigger myofascial actif, se sont révélées plus vite efficaces sur l'amélioration de l'intensité douloureuse, de la fonction physique et de la qualité de vie, que la pratique d'un programme d'exercices à domicile. Ils n'ont pas observé de différence significative entre les deux types de pose, à l'exception des 36 facteurs définissant la qualité de vie, qui se sont améliorés plus précocement dans le groupe ayant bénéficié de la pose en inhibition musculaire.
Kinésiotaping; syndrome myofascial douloureux.
Prise en charge de la neuropathie du nerf pudendal
 |
Photo de Masha Raymers provenant de Pexels.com |
Levesque A. et al. Recommendations on the management of pudendal nerve entrapment syndrome: A formalised expert consensus. European Journal of Pain 2022, 26(1):7-17.
Recommandations sur la prise en charge du syndrome de piégeage du nerf pudendal : Un consensus formalisé d'experts.
Les auteurs proposent une synthèse de la littérature et des avis d'experts internationaux sur le diagnostic et la prise en charge de la neuropathie du nerf pudendal.
Cette pathologie n'est connue que depuis une vingtaine d'années et sa prise en charge reste hétérogène, elle varie en fonction du praticien. Depuis l'élaboration et la publication des critères diagnostiques du syndrome de compression du nerf pudendal en 2008, aucun travail complet n'a été publié sur les connaissances cliniques en lien avec sa prise en charge. L'objectif de ce travail est de développer des recommandations pour le diagnostic et la prise en charge de cette affection.
La méthodologie de cette étude s'appuie sur celle d'élaboration des bonnes pratiques de la Haute Autorité de Santé et la revue de la littérature est réalisée selon la méthode PRISMA. Les articles sélectionnés sont tous évalués selon la grille d'évaluation de l'American Society of Interventional Pain Physicians. Les résultats de l'analyse de la littérature et du consensus des experts sont intégrés dans 10 sections, pour décrire le diagnostic et la prise en charge de la neuropathie du nerf pudendal :
- Diagnostic de la neuropathie du nerf pudendal
- Conseils et précautions pour les patients
- Traitements médicamenteux
- Physiothérapie
- Électrostimulation transcutanée (TENS)
- Psychothérapie
- Injections
- Chirurgie
- Radiofréquence pulsée
- Neuromodulation
Les points majeurs suivants sont à noter : (i) la pertinence des critères de Nantes 4+1 pour le diagnostic ; (ii) la préférence pour une monothérapie initiale avec des tri-tétracycliques ou des gabapentinoïdes ; (iii) l'absence d'effet des opiacés, (iv) la pertinence probable (dans l'attente d'études mieux contrôlées) de la physiothérapie, du TENS et de la thérapie cognitivo-comportementale ; (v) les incertitudes (manque de données) concernant les injections de corticoïdes, (vi) la chirurgie est un traitement efficace à long terme et (vii) la radiofréquence nécessite un suivi plus long pour être actuellement proposée dans cette indication.
Ces recommandations devraient permettre une prise en charge rationnelle et homogène des patients souffrant d'une neurocompression du nerf pudendal. Elles devraient également permettre de raccourcir les délais de prise en charge en orientant les soins primaires.
Neuropathie ; nerf pudendal ; consensus experts ; diagnostic.
Dry Needling du muscle tibial postérieur

Photo provenant de l'International Journal of Sports Physical Therapy
Albin S. et al. Ultrasonographic Validation for Needle Placement in the Tibialis Posterior Muscle. IJSPT. 2021, 16(6):1541-1547.
Dry Needling du muscle tibial postérieur.
Le muscle tibial postérieur joue un rôle important dans la fonction normale du pied. Il est nécessaire d'adopter des approches thérapeutiques sûres et efficaces pour traiter ce muscle, cela représente un challenge vu sa localisation dans le plan profond de la loge postérieure de la jambe.
Le but de cette étude est d'évaluer avec précision le placement de l'aiguille dans le muscle tibial postérieur afin de ne pas blesser les structures neuro-vasculaires cheminant en profondeur dans la loge postérieure de la jambe.
Cet essai montre que l’introduction d'une aiguille de 50 mm à 60 mm insérée à une hauteur correspondant à la région comprise entre 30 et 50 % de la longueur du tibia mesurée à partir de l'articulation tibio-fémorale médiale, directement en arrière du tibia, en direction médio-latérale, dans le muscle tibial postérieur, évite les structures neuro-vasculaires de la région profonde de la loge postérieure de la jambe.
L'échographie a confirmé que le filament de l'aiguille a été inséré dans le muscle chez les 20 individus sains participant à l’essai et qu'il n'a pénétré le paquet vasculo-nerveux chez aucun d'entre eux. Les distances moyennes observées entre l'aiguille et le nerf tibial ainsi que l'artère tibiale postérieure étaient respectivement de 10,0 + 4,7 mm et de 10,2 + 4,7 mm. Le muscle était atteint à une profondeur moyenne de 25,8 + 4,9 mm de la peau.
Nous pensons, qu'il serait néanmoins souhaitable d'appliquer le Dry Needling du muscle tibial postérieur sous contrôle échographique, afin d'éviter les complications vasculo-nerveuses.
Dry Needling ; puncture sèche ; muscle tibial postérieur ; échographie.
Dermatome et fasciatome

Stecco C. et al. Dermatome and fasciatome. Clinical Anatomy 2019, 32(7):896-902.
Dermatome et fasciatome.
L'amélioration des connaissances sur l'innervation du fascia profond et sur organisation anatomique impose la réévaluation de la cartographie des dermatomes en fonction des nouvelles découvertes. Les auteurs distinguent dermatome et fasciatome, ils basent leur approche sur la littérature relative à la stimulation des racines nerveuses et la comparaison de la topographie des dermatomes et celle des myotomes. La première concerne la portion de tissu composée de la peau, de l'hypoderme et du fascia superficiel, innervée par toutes les branches cutanées originaires d´un même nerf rachidien. La deuxième concerne la portion du fascia profond innervée par la même racine nerveuse et organisée selon des lignes de force correspondant aux principales directions de mouvement. Le dermatome est important pour l'extéroception, tandis que le fasciatome est important pour la proprioception. S'ils sont altérés, le dermatome engendre une douleur clairement localisée et le fasciatome irradie la douleur en fonction de l'organisation de l'anatomie fasciale.
Innervation des fascias
Des recherches récentes montrent que le fascia profond est richement innervé (Stecco et al. 2007, Taguchi et al. 2013, Tesarz et al. 2011) et qu’il pourrait jouer un rôle dans la proprioception et dans la perception de la douleur. Les fibres nerveuses du fascia profond peuvent être soit peptidergiques, soit non peptidergiques. Taguchi et al. (2013) ont montré que les terminaisons nerveuses libres sont à la fois de type Aδ et C. Les fibres Aδ semblent être principalement sensibles aux stimuli mécaniques tels que le clampage, tandis que la plupart des fibres de type C sont polymodales (nocicepteurs) et donc sensibles à la fois aux stimuli mécaniques et chimiques (par exemple, à la bradykinine) ainsi qu' à la chaleur. En outre, les fibres C du fascia profond ont un seuil d'activation mécanique très élevé (1.854 mN), soit environ deux fois celui de la peau ou du muscle.
Schilder et al. (2014) ont constaté que la stimulation du fascia thoracolombal avec une solution saline hypertonique chez des volontaires sains pouvait générer une douleur, plus intense et plus irradiante que celle provoquée par l'injection de la même solution dans la masse musculaire des muscles érecteurs du rachis. Des résultats similaires ont été obtenus par Deising et al. (2012) avec des injections de facteur de croissance nerveuse dans le fascia thoracolombal. Schilder et al. (2018) ont conclu que la stimulation électrique de divers tissus mous de la région lombale révèle des caractéristiques différentes de la douleur en fonction de son origine : musculaire, fasciale ou cutanée, le caractère profond de la douleur indique que le muscle est le tissu concerné. La douleur brûlante ou la douleur vive caractérise un problème fascial.
Schilder et al. (2018) ont également souligné que les lombalgies d'origine fasciale ou cutanée peuvent conduire à une interprétation erronée et être considérées comme neuropathiques.
Ils ont aussi observé une sensibilisation à long terme des nocicepteurs du fascia profond à la pression mécanique et à la stimulation chimique avec des acides. Ce mécanisme pourrait expliquer les douleurs musculo-squelettiques chroniques. Les mêmes auteurs ont montré que les terminaisons nerveuses libres du fascia sont stimulées plus efficacement lorsque le fascia est "pré-étiré" par une contraction musculaire. La stimulation électrique du fascia profond produit une douleur sourde et gênante, tandis que la même stimulation de l'hypoderme et du fascia superficiel produit une douleur aiguë et clairement localisée (Itoh et al. 2004).
Cela suggère que les deux types de fascia jouent des rôles différents : le fascia profond semble avoir une fonction principalement proprioceptive, tandis que le fascia superficiel semble coopérer avec la peau pour l'extéroception. La couche adipeuse intercalée entre les fascias (TAP = tissu adipeux profond) joue probablement un rôle d'isolation, permettant aux deux fascias de se mouvoir et d'être étirés indépendamment.
Les auteurs pensent que le TAP devrait être considéré comme la "ligne de partage des eaux" entre le système extéroceptif (formé de la peau, du tissu adipeux superficiel et des fascias superficiels) et le système proprioceptif (situé dans les muscles et les fascias profonds). Le tissu adipeux profond disparaît et où les fascias superficiel et profond fusionnent (comme dans la paume de la main et dans la plante pied), les systèmes exteroceptif et proprioceptif sont combinés. Cela facilite la perception de la forme, du volume, des surfaces des différents objets et, par conséquent, permet le mouvement, garantissant l'adaptation du pied et de la main aux différentes surfaces de contact. Les variations anatomiques existent et, de manière prévisible, les cartographies des dermatomes diffèrent entre les individus...
Dermatome - fasciatome - innervation - tissu adipeux profond
Douleur pelvi-périnéale chronique chez la femme
 |
Photo de Masha Raymers provenant de Pexels |
Lamvu G. et al. Chronic Pelvic Pain in Women: A Review. JAMA The Journal of the American Medical Association 2021, 325(23):2381-2391.
Douleur pelvienne chronique chez les femmes: Une revue.
La douleur pelvienne chronique est une affection qui touche environ 26 % de la population féminine mondiale. Aux États-Unis, la douleur pelvienne chronique est annuellement à l'origine de 40 % des laparoscopies et de 12 % des hystérectomies, son origine n'est cependant gynécologique que chez 20 % des patients. Les patients et les cliniciens sont souvent frustrés par le manque de ressources thérapeutiques. Cette revue traite de l'évaluation et de la prise en charge de la douleur pelvienne chronique, basées sur des recommandations issues de lignes directrices consensuelles, dont les objectifs sont de faciliter l'évaluation clinique, le traitement et d'améliorer les soins ainsi que les interactions patient-clinicien.
Les douleurs pelviennes chroniques se superposent souvent à d'autres syndromes douloureux tels que la fibromyalgie, la migraine... et à des comorbidités telles que des troubles du sommeil, de humeur ou cognitifs qui renforcent à la gravité du problème et contribuent à l'invalidité. Des douleurs et des dysfonctionnements musculo-squelettiques sont présents chez 50 à 90 % des patients atteints de douleur pelvienne chronique. Les expériences traumatiques et la détresse jouent un rôle important dans la modulation de la douleur. L'évaluation approfondie des facteurs biopsychosociaux qui contribuent à la douleur pelvienne chronique nécessite une anamnèse complète, l'éducation du patient sur les mécanismes de la douleur est primordiale et ces deux conditions imposent un allongement de la durée de consultation. Une formation aux soins tenant compte des traumatismes psychiques et physiques et à l'examen musculo-squelettique pelvien est essentielle pour réduire l'anxiété du patient associée à l'examen et identifier au mieux l'origine de la douleur myofasciale. Les traitements recommandés sont généralement multimodaux et nécessitent une équipe interdisciplinaire de cliniciens. Il convient d'éviter un examen orienté sur un seul organe. La participation du patient, la prise de décision partagée, la définition d'objectifs fonctionnels et une discussion sur les attentes du patient en matière de soins à long terme, sont des éléments importants du processus d'évaluation.
La douleur pelvienne chronique ressemble à d'autres syndromes de douleur chronique dans la mesure où les facteurs bio-psycho-sociaux interagissent et influencent la perception douloureuse. Les cliniciens doivent tenir compte des facteurs de médiation centrale de la douleur ainsi que des structures viscérales et somatiques pelviennes et non pelviennes qui peuvent générer ou contribuer à la douleur.
Douleur pelvienne chronique - douleur myofasciale - facteurs bio-psycho-sociaux.
Fascias et neuropathies
Stecco A. et al. Fascial entrapment neuropathy. Clinical Anatomy 2019, 32(7):883-890.
Neuropathies par enclavement fascial.
Les neuropathies de piégeage sont des conditions cliniques débilitantes, qui engendrent une morbidité importante au niveau de l’appareil locomoteur en termes de douleur, de perturbations sensorielles, et de faiblesse musculaire. Elles constituent un défi tant diagnostique que thérapeutique.
Les blocages pouvant avoir des origines multiples, une mauvaise appréhension de l'anatomie lors de l'examen peut conduire à un diagnostic erroné et à un traitement inadéquat.
En analysant leur anatomie, cet article met en exergue le rôle important que peuvent jouer les fascias dans ce syndrome.
Les structures neurales possèdent un microenvironnement spécifique, constitué de tissus conjonctifs tels que le fascia profond, les septums intermusculaires, l'épinèvre et le périnèvre. Les modifications de ces interfaces mécaniques peuvent se traduire par une perturbation de la mobilité du nerf, avec pour conséquence, une diminution de sa relative indépendance par rapport aux structures environnantes. Cette situation entraîne la constitution de points de fixation et de "lésions d'étirement intraneural". Les enclavements des nerfs décrits dans cet article soulignent l'importance du tissu conjonctif dans la génération de symptômes, dont l’origine peut être confondue avec des conditions cliniques plus courantes, comme des syndromes ou des dysfonctions musculo-squelettiques.
Les auteurs concluent que les origines fasciales des piégeages neuraux doivent être considérées comme un facteur important et doivent être prises en compte lors du diagnostic différentiel.
Neurofascias - piégeage - fascia profond - lésion d'étirement intraneural
Syndrome croisé supérieur
Nitayarak H., Charntaraviroj P. Effects of scapular stabilization exercises on posture and muscle imbalances in women with upper crossed syndrome: A randomized controlled trial. Journal of Back and Musculoskeletal Rehabilitation 2021, 34(6):1031-1040.
Effets des exercices de stabilisation scapulaire sur la posture et les déséquilibres musculaires chez les femmes souffrant d'un syndrome croisé supérieur : Un essai contrôlé randomisé.
Les exercices de stabilisation scapulaire semblent améliorer la posture d'enroulement des épaules vers l'avant chez les jeunes femmes. Cependant, les protocoles d'exercices dont les effets seraient optimaux sur les postures du cou et des épaules, le déséquilibre des muscles scapulaires et la cyphose thoracique, ne sont toujours pas clairs. L'étude examine les effets des exercices de stabilisation scapulaire sur les postures du cou et des épaules et la cyphose thoracique chez les jeunes femmes souffrant du syndrome croisé supérieur.
Trente-neuf patientes âgées de 18 à 25 ans souffrant du syndrome du croisé supérieur sont inclues dans l'essais. Les participantes ont été réparties au hasard en deux groupes. Le premier groupe a effectué des exercices de stabilisation scapulaire à l'aide de bandes élastiques à raison de 10 répétitions par série, 3 séries par jour, et 3 jours par semaine pendant 4 semaines. Le groupe témoin n'a effectué aucun exercice pendant la période expérimentale.
Dans le premier groupe des augmentations significatives de l'angle cervical et de l'angle de l'épaule, de la longueur du muscle petit pectoral et de la force des muscles scapulaires ont été mesurées, ce qui n'était pas le cas dans le groupe témoin. Cette étude indique que les exercices de stabilisation scapulaire peuvent améliorer la posture de la tête et des épaules, augmenter la souplesse du petit pectoral et renforcer les muscles scapulaires.
Le syndrome croisé supérieur se définit comme un déséquilibre musculaire dans la région de la tête et des épaules. On l'observe le plus souvent chez les personnes qui réalisent un travail de bureau ou passent la majeure partie de la journée en position assise dans une mauvaise posture. Le concept du syndrome croisé supérieur (Upper crossed syndrome - UCS) a été développé par le docteur Vladimir Janda dans les années 80. Selon lui, il peut être observé chez les sujets présentant une posture en protraction de la tête, une hyperlordose cervicale, une hypercyphose dorsale, une élévation et une protraction des épaules ainsi qu'une abduction des scapulas.
Les muscles affaiblis :
- Rhomboïdes
- Trapèze inférieur
- Dentelé antérieur
- Rotateurs de la coiffe postérieure
- Fléchisseurs profonds du cou
- Supra- et infrahyoïdiens
Les muscles tendus :
- Suboccipitaux
- Trapèze supérieur
- Élévateur de la scapula
- SCOM
- Pectoraux
- Scalènes
Ces changements posturaux entrainent ainsi un déséquilibre des muscles de la tête et de la ceinture scapulaire et sont fréquemment associés à des céphalées, des tensions mandibulaires, un syndrome du muscle trapèze, un syndrome de compression subacromial, un syndrome du défilé thoracique... et au développement des syndromes myofasciaux douloureux.
Douleur faciale chronique

Gerwin R. Chronic Facial Pain: Trigeminal Neuralgia, Persistent Idiopathic Facial Pain, and Myofascial Pain Syndrome - An Evidence-Based Narrative Review and Etiological Hypothesis. International Journal of Environmental Research and Public Health 2020, 17(19):7012-20 pages.
Douleur faciale chronique : névralgie du nerf trijumeau, douleur faciale idiopathique chronique et syndrome myofascial douloureux - Examen narratif fondé sur des données probantes et hypothèses étiologiques.
L'auteur analyse dans une étude narrative, les hypothèses étiologiques de la facialgie idiopathique chronique (FIC), qui dans certains cas peut être confondue avec une douleur trigéminale. Alors que les prises en charge de la névralgie du nerf trijumeau sont bien protocolées, ce n'est pas le cas pour la facialalgie idiopathique chronique. Le syndrome myofascial douloureux des muscles de la tête et du cou pourrait être à l'origine de ce syndrome. Robert Gerwin souligne que dans ce cas une approche thérapeutique spécifique serait appropriée. Il évoque des cas où la symptomatologie du nerf trijumeau et celle attribuée à la facialalgie idiopathique chronique se confondraient sur certains aspects. Remarquons que certaines tensions musculaires associées à la présence de points trigger myofasciaux peuvent être à l'origine d'une souffrance neurale, il s'agit d'un «syndrome canalaire», c'est ainsi que le nerf mandibulaire (V3) et ses branches peuvent être comprimées par les muscles ptérygoïdiens.
Anatomie et physiologie du nerf mandibulaire
Le nerf mandibulaire est issu de la réunion de deux racines : une racine sensitive, qui est issue du bord antérolatéral du ganglion trigéminal, et une racine motrice. Ces deux racines fusionnent au niveau du foramen oval de l'os sphénoïde qu'elles traversent. Dans la fosse infra-temporale, juste en dessous du foramen, le nerf mandibulaire donne naissance à une branche méningée récurrente puis après un court trajet se divise en deux troncs, l'un antérieur et l'autre postérieur, qui se divisent à leur tour.
Le tronc antérieur du nerf mandibulaire se divise en 3 branches :
- le nerf buccal ;
- le nerf temporal profond pour le muscle temporal ;
- le nerf massétérique pour le muscle masséter.
Le tronc postérieur du nerf mandibulaire se divise en 4 branches :
- le tronc commun des nerfs des muscles ptérygoïdiens, tenseur du voile du palais et tenseur du tympan ;
- le nerf auriculo-temporal ;
- le nerf alvéolaire inférieur ;
- le nerf lingual.
Le nerf mandibulaire est responsable de l'innervation sensitive :
- la peau de la tempe, de la joue, de la lèvre inférieure et du menton ;
- la muqueuse de la cavité buccale au niveau de la face médiale de la joue, des gencives, de la lèvre inférieure, de la région antérieure de la langue ;
- les dents inférieures ;
- les bourgeons gustatifs de la partie antérieure de la langue pour participer à la sensibilité gustative (neurones issus du nerf facial) ;
- les méninges de la fosse cérébrale moyenne.
Le nerf mandibulaire est responsable de l'innervation motrice :
- des muscles manducateurs : masséter, temporal, ptérygoïdiens médial et latéral ;
- d'autres muscles : tenseur du voile du palais, tenseur du tympan, mylo-hyoïdien et ventre antérieur du muscle digastrique.
Le nerf mandibulaire participe également à l'innervation autonome des glandes salivaires : la parotide d'une part (neurones issus du nerf glossopharyngien), et la submandibulaire et la sublinguale d'autre part (neurones issus du nerf facial).





